Etan (C2H6) là một trong những hợp chất hữu cơ cơ bản và quan trọng nhất, đóng vai trò nền tảng trong lĩnh vực hóa học hữu cơ và công nghiệp hóa dầu. Việc hiểu rõ công thức cấu tạo của etan không chỉ mở ra cánh cửa đến thế giới các hydrocarbon no mà còn là bước đệm để nắm bắt các phản ứng hóa học phức tạp hơn cùng những ứng dụng đa dạng của nó trong đời sống và sản xuất. Bài viết này sẽ đi sâu vào định nghĩa, cấu trúc không gian, tính chất vật lý và hóa học đặc trưng, các phương pháp điều chế cũng như những ứng dụng thiết yếu của etan, mang đến cái nhìn toàn diện về hợp chất thú vị này.
Etan và Vị Trí Của Nó Trong Dãy Ankan
Etan là thành viên thứ hai trong dãy đồng đẳng ankan, một nhóm các hydrocarbon no, mạch hở. Sự hiểu biết về etan bắt đầu từ việc đặt nó vào bối cảnh chung của các hợp chất ankan, những phân tử chỉ chứa liên kết đơn carbon-carbon (C-C) và carbon-hydro (C-H). Các ankan thường được biết đến với tính chất hóa học tương đối trơ, là do sự bền vững của các liên kết sigma này.
Định Nghĩa Và Phân Loại
Etan, với công thức phân tử C2H6, là một hydrocarbon no đơn giản, chỉ gồm hai nguyên tử carbon và sáu nguyên tử hydro. Nó thuộc nhóm ankan, hay còn gọi là parafin, được đặc trưng bởi việc tất cả các liên kết giữa các nguyên tử trong phân tử đều là liên kết đơn. Công thức chung cho các ankan là CnH2n+2, với ‘n’ là số nguyên tử carbon. Đối với etan, n=2, do đó có công thức C2H(22+2) = C2H6.
Trong danh pháp IUPAC, tên gọi “etan” xuất phát từ tiền tố “et-” chỉ hai nguyên tử carbon và hậu tố “-an” chỉ thuộc dãy ankan. Cùng với metan, etan là một trong những hydrocarbon nhỏ nhất, đóng vai trò là khối xây dựng cơ bản cho các hợp chất hữu cơ phức tạp hơn. Để hiểu rõ hơn về cách tìm công thức hóa học, trước tiên cần nắm vững các nguyên tắc cơ bản của liên kết hóa học và sự sắp xếp nguyên tử, điều này đặc biệt quan trọng khi xác định công thức cho các hợp chất hữu cơ như etan.
Đặc Điểm Chung Của Ankan
Ankan là những hợp chất hữu cơ đơn giản nhất về mặt cấu trúc hóa học, không có liên kết bội hay nhóm chức phức tạp. Đặc điểm nổi bật của chúng là sự hiện diện của các liên kết sigma bền vững giữa carbon với carbon và carbon với hydro. Các liên kết này có tính định hướng không gian rõ rệt, góp phần tạo nên cấu trúc hình học ổn định cho phân tử.
Khả năng tạo thành mạch carbon dài, thẳng hoặc phân nhánh, nhưng chỉ với liên kết đơn, là đặc trưng của ankan. Sự “no” của ankan – tức là không thể kết hợp thêm nguyên tử hydro – cũng là yếu tố quyết định tính chất hóa học tương đối ít phản ứng của chúng. Ankan là nền tảng cho ngành công nghiệp dầu khí, là thành phần chính của khí thiên nhiên và dầu mỏ, và là nguyên liệu thô quan trọng cho nhiều quy trình tổng hợp hóa học. Việc nắm vững các nguyên lý cơ bản về ankan sẽ giúp người học dễ dàng tiếp cận với các khái niệm hóa học hữu cơ phức tạp hơn. Các kiến thức này được trình bày chi tiết trên lophoctichcuc.com, cung cấp một nguồn tài liệu đáng tin cậy cho những ai muốn mở rộng hiểu biết về lĩnh vực này.
Giải Mã Công Thức Cấu Tạo Của Etan
Việc giải mã công thức cấu tạo của etan là trọng tâm để hiểu sâu sắc về hợp chất này. Từ công thức phân tử C2H6, chúng ta có thể suy ra cách các nguyên tử được sắp xếp và liên kết với nhau trong không gian, từ đó hình dung được hình dạng và đặc điểm cấu trúc của etan. Đây là bước quan trọng để dự đoán và giải thích các tính chất hóa học của nó.
Công Thức Phân Tử và Công Thức Cấu Tạo Rút Gọn
Công thức cấu tạo của etan được biểu diễn một cách trực quan nhất là CH3-CH3. Công thức phân tử C2H6 chỉ cho biết số lượng nguyên tử mỗi loại có trong phân tử, nhưng không thể hiện cách chúng liên kết với nhau. Công thức cấu tạo rút gọn, CH3-CH3, đã cung cấp thêm thông tin về sự sắp xếp này: hai nhóm metyl (CH3) được nối với nhau bằng một liên kết đơn carbon-carbon.
Trong cấu trúc này, mỗi nguyên tử carbon liên kết trực tiếp với ba nguyên tử hydro và một nguyên tử carbon khác. Tổng cộng có sáu liên kết C-H và một liên kết C-C trong phân tử etan. Các liên kết này đều là liên kết sigma, có đặc tính bền vững và hướng về bốn đỉnh của một hình tứ diện đều, điều này tạo nên tính chất không phân cực và tương đối trơ về mặt hóa học cho etan.
Cấu Trúc Không Gian và Liên Kết Hóa Học
Trong phân tử etan, mỗi nguyên tử carbon đều trải qua quá trình lai hóa sp3. Điều này có nghĩa là một nguyên tử carbon sử dụng một obitan s và ba obitan p để tạo thành bốn obitan lai hóa sp3, mỗi obitan hướng về một đỉnh của hình tứ diện đều. Kết quả là, cả hai nguyên tử carbon trong etan đều có hình học tứ diện, và liên kết C-C nằm trên trục nối hai tâm tứ diện này.
Góc liên kết H-C-H và H-C-C trong etan đều xấp xỉ 109.5 độ, đúng với góc tứ diện chuẩn. Độ dài liên kết C-C là khoảng 1.54 Å (Angstrom), điển hình cho một liên kết đơn carbon-carbon, và độ dài liên kết C-H là khoảng 1.09 Å. Điều đặc biệt là, do liên kết C-C là liên kết đơn, các nhóm metyl ở hai đầu phân tử có thể quay tự do tương đối quanh trục liên kết này. Sự quay tự do này tạo ra các cấu dạng (conformations) khác nhau của etan, đáng chú ý nhất là cấu dạng xen kẽ (staggered) và cấu dạng che khuất (eclipsed). Cấu dạng xen kẽ ổn định hơn do lực đẩy không gian giữa các nguyên tử hydro ở hai nhóm metyl là nhỏ nhất.
Biểu Diễn Công Thức Cấu Tạo Chi Tiết
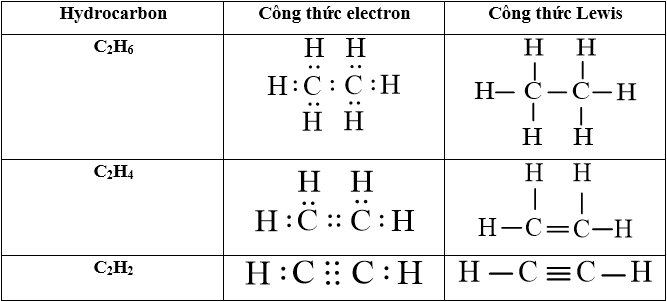
Để biểu diễn công thức cấu tạo của etan một cách đầy đủ và chi tiết, có thể sử dụng nhiều phương pháp khác nhau, mỗi phương pháp mang lại một góc nhìn riêng về cấu trúc phân tử. Công thức Lewis là cách biểu diễn đơn giản nhất, hiển thị tất cả các nguyên tử và cặp electron liên kết, cũng như cặp electron không liên kết (nếu có). Trong etan, mỗi nguyên tử carbon được bao quanh bởi tám electron (hai ở mỗi liên kết), và mỗi nguyên tử hydro được bao quanh bởi hai electron.
Khi vẽ công thức cấu tạo đầy đủ, tất cả các liên kết C-C và C-H đều được vẽ bằng các gạch nối, thể hiện rõ ràng mối liên kết giữa từng cặp nguyên tử. Để thể hiện cấu trúc không gian ba chiều, người ta thường dùng công thức phối cảnh (wedge-dash notation), trong đó các liên kết hướng về phía người xem được vẽ bằng nét đậm (nêm), và các liên kết hướng ra xa người xem được vẽ bằng nét đứt.
Đối với các cấu dạng, hình chiếu Newman là một công cụ cực kỳ hữu ích. Nó cho phép nhìn thẳng dọc theo trục liên kết C-C, biểu diễn các nguyên tử hoặc nhóm nguyên tử trên carbon phía trước bằng các đường xuất phát từ tâm, và các nhóm trên carbon phía sau bằng các đường xuất phát từ chu vi của một vòng tròn lớn. Qua hình chiếu Newman, sự khác biệt giữa cấu dạng xen kẽ (staggered) và che khuất (eclipsed) trở nên rõ ràng. Trong cấu dạng xen kẽ, các nguyên tử hydro của carbon phía trước nằm ở giữa các nguyên tử hydro của carbon phía sau, tạo ra sự phân bố không gian tối ưu và năng lượng thấp nhất. Ngược lại, trong cấu dạng che khuất, các nguyên tử hydro trùng khớp nhau khi nhìn dọc theo trục, gây ra lực đẩy không gian và năng lượng cao hơn.
Đồng Phân Của Etan: Sự Đơn Giản Trong Cấu Trúc
Khái niệm đồng phân là một trong những nền tảng của hóa học hữu cơ, mô tả các hợp chất có cùng công thức phân tử nhưng khác nhau về cấu trúc hoặc cách sắp xếp các nguyên tử trong không gian. Tuy nhiên, khi xét đến etan, chúng ta sẽ thấy sự đơn giản đến mức nó không thể hình thành các loại đồng phân phổ biến.
Khái Niệm Đồng Phân Cấu Tạo
Đồng phân cấu tạo là hiện tượng các hợp chất có cùng công thức phân tử nhưng lại có trật tự liên kết giữa các nguyên tử khác nhau. Điều này dẫn đến sự khác biệt về cấu trúc hóa học và do đó, khác biệt về tính chất vật lý và hóa học. Ví dụ điển hình là n-butan và isobutan, cả hai đều có công thức phân tử C4H10 nhưng n-butan có mạch carbon thẳng, còn isobutan có mạch carbon phân nhánh. Sự khác biệt này làm cho chúng có điểm sôi, điểm nóng chảy và các phản ứng hóa học khác nhau.
Tại Sao Etan Không Có Đồng Phân Cấu Tạo?
Với chỉ hai nguyên tử carbon và sáu nguyên tử hydro, công thức cấu tạo của etan (CH3-CH3) là cách duy nhất để sắp xếp các nguyên tử này mà không tạo ra liên kết bội hoặc cấu trúc vòng. Không thể có bất kỳ sự phân nhánh nào vì chỉ có hai carbon được liên kết với nhau. Để một ankan có đồng phân cấu tạo mạch carbon, nó cần phải có ít nhất bốn nguyên tử carbon, cho phép sự hình thành của mạch thẳng (n-butan) và mạch nhánh (isobutan).
Hơn nữa, etan cũng không có đồng phân hình học (cis-trans) vì tất cả các liên kết đều là liên kết đơn, cho phép quay tự do. Nó cũng không có đồng phân quang học vì không có nguyên tử carbon bất đối xứng (carbon chiral) – tức là một carbon liên kết với bốn nhóm thế khác nhau. Mỗi carbon trong etan chỉ liên kết với một carbon và ba hydro, là các nhóm thế giống nhau. Sự đối xứng cao trong phân tử etan là lý do chính cho sự thiếu vắng các dạng đồng phân này. Sự đơn giản trong cấu trúc này cũng phản ánh tính chất hóa học tương đối ổn định và dễ dự đoán của etan.
Tính Chất Vật Lý và Hóa Học Đặc Trưng Của Etan
Etan, với cấu trúc đơn giản nhưng cân đối, thể hiện những tính chất vật lý và hóa học đặc trưng của một ankan điển hình. Việc nắm vững những tính chất này là chìa khóa để hiểu về hành vi của etan trong các điều kiện khác nhau và các ứng dụng của nó.
Tính Chất Vật Lý
Etan là một chất khí không màu, không mùi ở nhiệt độ và áp suất phòng. Đây là một đặc điểm chung của các ankan có số nguyên tử carbon thấp (từ C1 đến C4).
- Nhiệt độ sôi và nóng chảy: Etan có nhiệt độ sôi rất thấp (-88.6 °C) và nhiệt độ nóng chảy cũng thấp (-182.8 °C). Điều này là do giữa các phân tử etan chỉ tồn tại lực Van der Waals yếu (lực London), là loại lực liên phân tử yếu nhất. Với khối lượng phân tử nhỏ, các lực này không đủ mạnh để giữ các phân tử lại với nhau ở nhiệt độ cao hơn, khiến etan dễ dàng chuyển sang trạng thái khí.
- Độ tan: Etan là một phân tử không phân cực, do đó nó rất ít tan trong các dung môi phân cực như nước. Ngược lại, nó tan tốt trong các dung môi hữu cơ không phân cực như benzen, dietyl ete, hoặc các ankan khác. Quy tắc “like dissolves like” (chất giống nhau tan trong nhau) rất rõ ràng ở đây.
- Khối lượng riêng: Với khối lượng mol khoảng 30.07 g/mol, etan nhẹ hơn không khí (khối lượng mol trung bình của không khí khoảng 29 g/mol). Khi thoát ra ngoài môi trường, etan có xu hướng bay lên cao.
Khi xem xét các đặc tính vật lý của hydrocarbon như etan, cần lưu ý rằng chúng có thể khác biệt đáng kể so với các hợp chất khác, ví dụ như đimetyl oxalat công thức – một este có tính chất phân cực và điểm sôi cao hơn nhiều do có nhóm carbonyl và hai nhóm este, tạo ra lực liên phân tử mạnh hơn.
Tính Chất Hóa Học
Etan, giống như các ankan khác, được biết đến với tính chất hóa học tương đối trơ, ít phản ứng. Điều này xuất phát từ sự bền vững của các liên kết sigma C-C và C-H, cùng với độ phân cực thấp của chúng. Tuy nhiên, etan vẫn tham gia vào một số phản ứng quan trọng dưới điều kiện thích hợp.
-
Tính Trơ (Kém Hoạt Động): Các liên kết trong etan đều là liên kết đơn và không có electron pi tự do, làm cho chúng ít bị tấn công bởi các tác nhân nucleophil hay electrophil. Etan không phản ứng với axit, bazơ, hoặc các chất oxy hóa mạnh ở điều kiện thường.
-
Phản Ứng Đốt Cháy (Oxy Hóa Hoàn Toàn): Đây là phản ứng quan trọng nhất của etan từ góc độ ứng dụng năng lượng. Etan cháy hoàn toàn trong điều kiện dư oxy, tạo ra carbon dioxide (CO2) và nước (H2O), đồng thời giải phóng một lượng lớn nhiệt. Đây là phản ứng tỏa nhiệt mạnh, biến etan thành một nguồn nhiên liệu hiệu quả. C2H6 (khí) + 7/2 O2 (khí) → 2 CO2 (khí) + 3 H2O (lỏng) + Năng lượng Hoặc cân bằng với hệ số nguyên: 2C2H6 (khí) + 7 O2 (khí) → 4 CO2 (khí) + 6 H2O (lỏng) + Năng lượng Phản ứng này cho thấy etan là một “nhiên liệu sạch” tương đối, ít tạo ra muội than so với các hydrocarbon không no.
-
Phản Ứng Thế Halogen (Phản Ứng Gốc Tự Do): Đây là phản ứng đặc trưng của ankan, trong đó một hoặc nhiều nguyên tử hydro bị thay thế bởi nguyên tử halogen (Clo, Brom). Phản ứng này xảy ra dưới tác dụng của ánh sáng cực tím (UV) hoặc nhiệt độ cao và diễn ra theo cơ chế gốc tự do. Ví dụ với Clo: CH3-CH3 + Cl2 -(ánh sáng UV)-> CH3-CH2Cl (cloetan) + HCl Phản ứng có thể tiếp tục, thay thế các nguyên tử hydro còn lại bằng halogen, tạo ra các dẫn xuất polyhalogenated. Cơ chế phản ứng bao gồm ba giai đoạn: khơi mào (tạo gốc tự do halogen), phát triển (gốc halogen tấn công ankan, tạo gốc ankan và gốc ankan tấn công phân tử halogen), và kết thúc (gốc tự do kết hợp với nhau).
-
Phản Ứng Cracking (Nhiệt Phân): Ở nhiệt độ rất cao (trên 500°C) và/hoặc có mặt chất xúc tác, etan có thể bị phân hủy thành các hydrocarbon có mạch carbon ngắn hơn và/hoặc các hydrocarbon không no (alken). Phản ứng này được gọi là cracking hoặc nhiệt phân. Ví dụ: CH3-CH3 -(nhiệt độ cao)-> CH2=CH2 (etilen) + H2 (hydro) Đây là một phản ứng cực kỳ quan trọng trong công nghiệp hóa dầu vì nó là phương pháp chính để sản xuất etilen, một trong những nguyên liệu hóa học cơ bản nhất. Trong quá trình nhiệt phân, các phân tử lớn bị bẻ gãy thành các phân tử nhỏ hơn. Điều này cũng liên quan đến việc biến đổi các hợp chất hữu cơ phức tạp thành dạng đơn giản hơn, tương tự như việc tìm hiểu este x có công thức phân tử c9h10o2 có thể bao gồm việc phân tích các thành phần cấu tạo đơn giản hơn của nó.
-
Phản Ứng Dehydro Hóa (Tách Hydro): Đây là một dạng cụ thể của cracking, tập trung vào việc tách các nguyên tử hydro để tạo thành liên kết đôi. CH3-CH3 -(nhiệt độ cao, xúc tác)-> CH2=CH2 + H2 Phản ứng này cũng là một con đường để sản xuất etilen.
Điều Chế Etan: Từ Thiên Nhiên Đến Phòng Thí Nghiệm
Etan là một hợp chất có sẵn trong tự nhiên, nhưng cũng có thể được tổng hợp trong phòng thí nghiệm hoặc quy mô công nghiệp thông qua nhiều phương pháp khác nhau. Các phương pháp này tận dụng các nguồn nguyên liệu khác nhau và cơ chế phản ứng hóa học đặc trưng để tạo ra etan.
Nguồn Gốc Tự Nhiên
Nguồn chính của etan là các mỏ khí thiên nhiên và dầu mỏ.
- Khí thiên nhiên: Etan là thành phần chính thứ hai (sau metan) trong khí thiên nhiên. Hàm lượng etan trong khí thiên nhiên dao động tùy thuộc vào nguồn mỏ, có thể từ vài phần trăm đến hơn 20%. Etan được tách ra khỏi hỗn hợp khí thiên nhiên thông qua quá trình chưng cất phân đoạn ở nhiệt độ rất thấp (cryogenic separation), tận dụng sự khác biệt về điểm sôi giữa các hydrocarbon.
- Dầu mỏ: Etan cũng được tìm thấy với một lượng nhỏ trong dầu mỏ thô và được thu hồi như một sản phẩm phụ trong quá trình lọc dầu và các quy trình cracking hydrocarbon nặng hơn.
Phương Pháp Tổng Hợp Trong Phòng Thí Nghiệm
Trong phòng thí nghiệm, etan có thể được điều chế bằng một số phương pháp tổng hợp hữu cơ kinh điển:
-
Phản ứng Wurtz: Đây là một phương pháp tổng hợp ankan đối xứng từ các halogenua ankan và kim loại natri. Để điều chế etan, cần sử dụng metyl halogenua (ví dụ: metyl bromua – CH3Br). 2CH3Br + 2Na → CH3-CH3 + 2NaBr Phản ứng này thường được thực hiện trong dung môi ete khan để tránh phản ứng phụ với nước. Phản ứng Wurtz hiệu quả nhất khi tổng hợp các ankan đối xứng.
-
Điện phân Kolbe: Phương pháp này sử dụng quá trình điện phân dung dịch muối natri (hoặc kali) của axit cacboxylic. Để thu được etan, người ta điện phân dung dịch muối natri axetat (CH3COONa). 2CH3COONa + 2H2O -(điện phân)-> CH3-CH3 + 2CO2 + H2 + 2NaOH Tại cực dương, anion axetat bị oxy hóa, mất electron và phân hủy tạo ra gốc metyl tự do, sau đó hai gốc metyl kết hợp lại thành etan.
-
Hydro hóa Anken/Ankin: Đây là một phương pháp rất phổ biến để điều chế ankan từ các hydrocarbon không no. Bằng cách cho etilen (anken) hoặc axetilen (ankin) phản ứng với hydro có mặt chất xúc tác kim loại (như niken (Ni), platin (Pt), hoặc palađi (Pd)) ở nhiệt độ thích hợp, ta có thể thu được etan. CH2=CH2 (etilen) + H2 -(Ni, Pt, Pd; nhiệt độ)-> CH3-CH3 (etan) CH≡CH (axetilen) + 2H2 -(Ni, Pt, Pd; nhiệt độ)-> CH3-CH3 (etan) Quá trình này bổ sung các nguyên tử hydro vào liên kết bội, biến hợp chất không no thành hợp chất no. Quá trình hydro hóa là một phương pháp quan trọng để tạo ra các ankan no từ các hợp chất không no, đồng thời, việc tính toán lượng chất phản ứng và sản phẩm tương tự như khi tìm hiểu công thức tính nồng độ rượu đòi hỏi sự chính xác về định lượng và cân bằng phản ứng.
Ứng Dụng Đa Dạng Của Etan Trong Công Nghiệp Và Đời Sống
Mặc dù công thức cấu tạo của etan rất đơn giản, nhưng hợp chất này lại có vai trò vô cùng quan trọng và ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp và đời sống hàng ngày. Từ nguồn năng lượng đến nguyên liệu thô cho ngành hóa chất, etan đã và đang góp phần không nhỏ vào sự phát triển kinh tế và công nghệ.
Nhiên Liệu
Etan là một nguồn năng lượng hiệu quả. Nó có thể được đốt trực tiếp để sản xuất nhiệt và điện, đặc biệt ở những khu vực có nguồn khí thiên nhiên dồi dào. Khí thiên nhiên, trong đó etan là thành phần đáng kể, được sử dụng rộng rãi làm nhiên liệu cho nhà máy điện, lò sưởi gia đình và các quy trình công nghiệp khác. Mặc dù propan và butan phổ biến hơn trong khí hóa lỏng (LPG), etan cũng đôi khi được sử dụng làm nhiên liệu cho một số ứng dụng đặc biệt hoặc làm thành phần pha trộn trong các hỗn hợp nhiên liệu.
Nguyên Liệu Quan Trọng Trong Công Nghiệp Hóa Dầu
Ứng dụng quan trọng nhất của etan là làm nguyên liệu cho ngành công nghiệp hóa dầu, đặc biệt là trong sản xuất etilen (ethylene).
- Sản xuất Etylen (Ethylene): Khoảng 90% lượng etan được sản xuất trên thế giới được sử dụng để điều chế etilen thông qua quá trình cracking hơi nước (steam cracking). Trong quá trình này, etan được nung nóng ở nhiệt độ cao (thường từ 800-900°C) mà không có oxy, tạo ra etilen và hydro. Etylen là monome cơ bản để sản xuất polyetylen (PE), một trong những loại nhựa được sản xuất nhiều nhất và có ứng dụng đa dạng nhất, từ bao bì, màng nhựa đến ống dẫn, đồ gia dụng.
- Sản xuất các dẫn xuất khác: Từ etilen, có thể điều chế hàng loạt các hợp chất hữu cơ khác như etanol (rượu etylic), etylen oxit (dùng trong sản xuất chất chống đông, polyester), vinyl clorua (monome để sản xuất PVC), etyl benzen (tiền chất của styren và polystyren). Sự chuyển hóa từ etan thành etilen, rồi từ etilen thành các sản phẩm hóa học khác, hình thành một chuỗi giá trị quan trọng trong ngành công nghiệp hóa chất. Etan đóng vai trò là tiền chất cho nhiều hợp chất khác, bao gồm cả các este phức tạp. Chẳng hạn, công thức vinyl benzoat là một ví dụ về một este có cấu trúc phức tạp hơn, được tổng hợp thông qua nhiều bước từ các hợp chất hữu cơ cơ bản, có thể liên quan đến các sản phẩm từ etan.
Chất Làm Lạnh
Do có điểm sôi rất thấp (-88.6 °C), etan đôi khi được sử dụng làm chất làm lạnh trong các hệ thống làm lạnh công nghiệp ở nhiệt độ cực thấp, đặc biệt là trong các quy trình hóa học yêu cầu nhiệt độ cryogenic (dưới -150 °C). Etan là một lựa chọn thay thế cho các chất làm lạnh khác trong một số ứng dụng chuyên biệt do tính chất nhiệt động lực học của nó.
Các Ứng Dụng Khác
- Khí chuẩn: Etan được sử dụng làm khí chuẩn trong các thiết bị phân tích khí, giúp hiệu chuẩn các máy móc đo lường nồng độ khí khác nhau.
- Chất đẩy: Trong một số sản phẩm aerosol, etan có thể được sử dụng làm chất đẩy do tính chất khí và không độc hại ở nồng độ thấp.
- Nghiên cứu khoa học: Etan là một phân tử mẫu lý tưởng để nghiên cứu các liên kết carbon-carbon, cấu dạng và động học phân tử trong hóa học hữu cơ.
Lưu Ý Về An Toàn Khi Xử Lý Etan
Mặc dù etan là một hydrocarbon tương đối đơn giản và được sử dụng rộng rãi, việc xử lý và lưu trữ nó đòi hỏi tuân thủ nghiêm ngặt các quy tắc an toàn. Hiểu rõ các mối nguy hiểm tiềm ẩn là cần thiết để phòng tránh tai nạn và bảo vệ sức khỏe con người.
Nguy Cơ Cháy Nổ
Mối nguy hiểm lớn nhất của etan là tính dễ cháy. Etan là một chất khí dễ bắt lửa và có thể tạo thành hỗn hợp nổ với không khí trong một phạm vi nồng độ rộng. Nhiệt độ bắt cháy rất thấp, và một nguồn nhiệt nhỏ, tia lửa điện, hoặc tĩnh điện cũng có thể gây ra cháy hoặc nổ nghiêm trọng.
Do đó, khi lưu trữ và sử dụng etan, cần đảm bảo các điều kiện sau:
- Thông gió đầy đủ: Khu vực làm việc phải có hệ thống thông gió tốt để ngăn chặn sự tích tụ của etan trong không khí.
- Tránh xa nguồn nhiệt và tia lửa: Không được để etan gần các nguồn phát nhiệt, ngọn lửa trần, thiết bị điện không chống cháy nổ, hoặc các nguồn tĩnh điện.
- Thiết bị chống cháy nổ: Sử dụng thiết bị điện và công cụ không phát tia lửa trong môi trường có etan.
- Hệ thống cảnh báo: Lắp đặt các cảm biến khí để phát hiện rò rỉ và cảnh báo kịp thời.
Nguy Hiểm Sức Khỏe
Etan không được coi là một chất độc hại trực tiếp theo nghĩa nó không gây nhiễm độc cho cơ thể ở nồng độ thấp. Tuy nhiên, nó là một chất gây ngạt đơn giản. Điều này có nghĩa là, ở nồng độ cao trong không khí, etan có thể làm giảm nồng độ oxy, dẫn đến tình trạng thiếu oxy trong cơ thể. Các triệu chứng ngạt thở bao gồm chóng mặt, buồn nôn, mất ý thức và có thể dẫn đến tử vong nếu không được cung cấp oxy kịp thời.
Để đảm bảo an toàn về sức khỏe:
- Tránh hít phải nồng độ cao: Đảm bảo làm việc trong môi trường được thông gió tốt.
- Thiết bị bảo hộ cá nhân (PPE): Mặc dù không cần thiết cho việc tiếp xúc trực tiếp thông thường, trong các tình huống có nguy cơ rò rỉ lớn, việc sử dụng mặt nạ phòng độc hoặc thiết bị thở độc lập là cần thiết.
- Huấn luyện an toàn: Người làm việc với etan cần được huấn luyện về các quy trình an toàn, cách nhận biết rò rỉ và ứng phó khẩn cấp.
Việc tuân thủ các quy định về an toàn lao động và hóa chất là tối quan trọng khi xử lý etan để ngăn ngừa các sự cố không mong muốn, bảo vệ tính mạng và tài sản.
Việc tìm hiểu về công thức cấu tạo của etan là bước khởi đầu quan trọng để khám phá sâu hơn về thế giới hóa học hữu cơ. Từ cấu trúc hai carbon đơn giản, etan mở ra một loạt các tính chất vật lý và hóa học đặc trưng, là cơ sở cho nhiều ứng dụng thiết yếu. Từ vai trò là thành phần chính trong khí thiên nhiên, cung cấp năng lượng cho các ngành công nghiệp, đến việc là nguyên liệu hóa học quan trọng để sản xuất etilen và nhiều dẫn xuất khác, etan đã chứng tỏ giá trị không thể phủ nhận. Với cấu trúc đơn giản nhưng ý nghĩa sâu rộng, etan không chỉ là một hợp chất hóa học cơ bản mà còn là một trụ cột trong nhiều ngành công nghiệp và nghiên cứu khoa học, góp phần định hình cuộc sống hiện đại của chúng ta.