Trong ngành công nghiệp hóa chất hiện đại, phản ứng chuyển hóa Etilen (C2H4) thành Ethanol (C2H5OH) được xem là một trong những quy trình “xương sống” để sản xuất cồn sinh học, dung môi công nghiệp và nhiên liệu sạch.
Không chỉ đơn thuần là một phương trình hóa học trong sách giáo khoa, quy trình này tại các nhà máy đòi hỏi sự kiểm soát nghiêm ngặt về nhiệt độ, áp suất và chất xúc tác. Tại bài viết này, VIETCHEM sẽ cùng bạn đi sâu phân tích từ lý thuyết cơ bản đến ứng dụng thực tế của phản ứng hydrat hóa Etilen.
1. Phương trình phản ứng C2H4 ra C2H5OH (Phản ứng Hydrat hóa)
Phản ứng điều chế Ethanol từ Etilen thực chất là phản ứng cộng nước (Hydrat hóa) vào liên kết đôi của Anken. Đây là phương pháp chủ yếu để tổng hợp Ancol Etylic ở quy mô công nghiệp.
Phương trình tổng quát
C2H4 + H2O (H2SO4/H3PO4, t0, P) → C2H5OH
Trong đó:
- Chất tham gia: Etilen (CH2=CH2) và Nước (H2O – thường ở dạng hơi nước quá nhiệt).
- Sản phẩm: Etanol (C2H5OH – Ancol Etylic).
Điều kiện phản ứng chuẩn
Để phản ứng xảy ra với hiệu suất cao nhất trong công nghiệp, các kỹ sư hóa chất cần thiết lập các thông số sau:
- Nhiệt độ: Khoảng 300độ C.
- Áp suất: 70 – 80 atm.
- Chất xúc tác: Axit Sulfuric (H2SO4) hoặc Axit Phosphoric (H3PO4) tẩm trên chất mang (như Zeolite hoặc Silica).
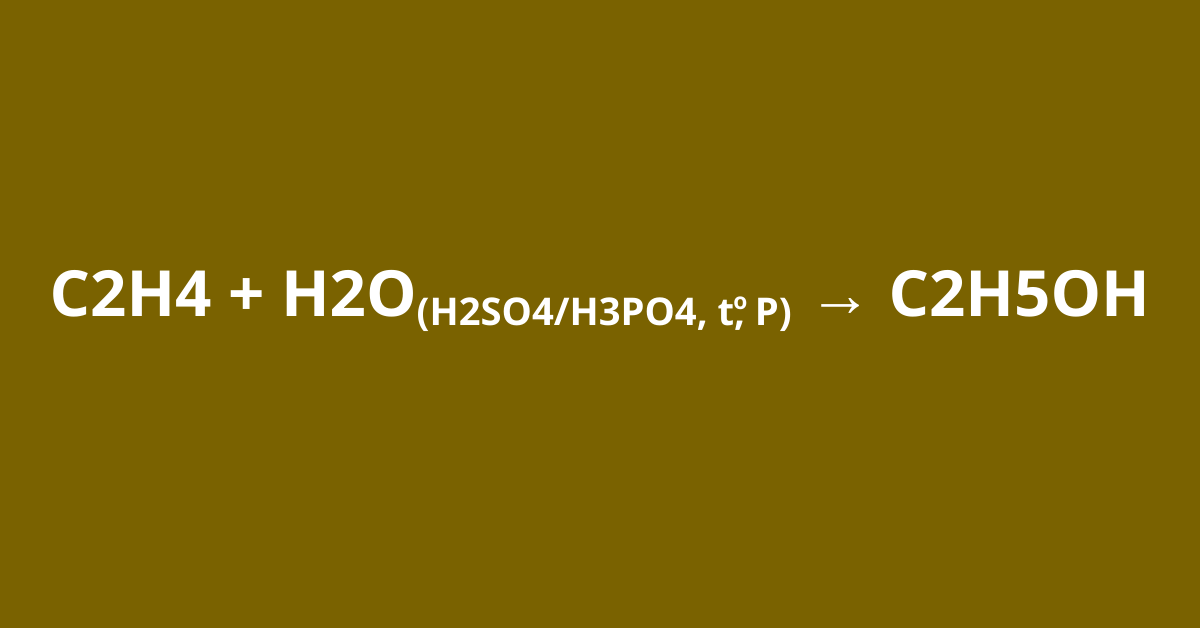
Lưu ý từ chuyên gia VIETCHEM: Phản ứng này là phản ứng thuận nghịch và tỏa nhiệt. Do đó, việc duy trì áp suất cao là cần thiết để cân bằng chuyển dịch theo chiều thuận (tạo ra Ethanol) theo nguyên lý Le Chatelier.
2. Cơ chế phản ứng cộng nước vào Etilen (Góc nhìn chuyên sâu)
Tại sao cần xúc tác Axit (H+)? Nước là một chất phân cực nhưng khả năng phân ly yếu, không đủ mạnh để tự tấn công vào liên kết đôi bền vững của Etilen. Dưới đây là cơ chế cộng Electrophile (AE) chi tiết:
- Bước 1: Proton hóa (Tạo Carbocation).Ion H+ từ axit xúc tác sẽ tấn công vào liên kết đôi pi giàu electron của C2H4, bẻ gãy liên kết này và tạo thành một Carbocation trung gian (C2H5+) kém bền.CH2=CH2 + H+ → CH3-CH2+
- Bước 2: Tác kích Nucleophin.Phân tử nước (H2O – đóng vai trò là tác nhân Nucleophin) với cặp electron tự do sẽ tấn công vào Carbocation mang điện dương.CH3-CH2+ + H2O → CH3-CH2-OH2+
- Bước 3: Tách Proton (Hoàn trả xúc tác).Ion oxonium (CH3-CH2-OH2+) sẽ tách một proton H+ ra để trở thành phân tử Ethanol bền vững. Ion H+ này quay lại vòng phản ứng, đó là lý do xúc tác không bị tiêu hao.
3. Quy trình sản xuất Ethanol từ Ethylene trong công nghiệp hóa chất
Khác với quy mô phòng thí nghiệm, trong nhà máy hóa chất (như các nhà máy của Shell, Total…), việc sản xuất hàng ngàn tấn Ethanol mỗi ngày yêu cầu công nghệ tối ưu. Hiện nay có hai phương pháp chính:
Phương pháp Hydrat hóa trực tiếp (Direct Hydration)
Đây là công nghệ hiện đại nhất, sử dụng xúc tác rắn (H3PO4 trên chất mang Silica hoặc Diatomite).
- Quy trình: Hỗn hợp khí Etilen và hơi nước (tỷ lệ mol 1:0.6) được nén và đưa qua tháp phản ứng chứa xúc tác ở 300độ C.
- Ưu điểm: Hiệu suất chuyển hóa cao, ít tạo sản phẩm phụ, không gây ăn mòn thiết bị nghiêm trọng.
Phương pháp Hydrat hóa gián tiếp (Indirect Hydration)
Đây là phương pháp cổ điển (phát minh năm 1930), sử dụng H2SO4 đậm đặc.
- Quy trình: Etilen được hấp thụ vào Axit Sulfuric đậm đặc để tạo thành Este (Etyl Sunfat), sau đó thủy phân Este này để ra Ethanol.
- Nhược điểm: Môi trường axit đặc gây ăn mòn đường ống dẫn, chi phí tái sinh axit rất lớn. Hiện nay công nghệ này ít được sử dụng cho quy mô lớn.
Bảng so sánh 2 công nghệ sản xuất Ethanol:
Tiêu chí so sánh
Hydrat hóa Trực tiếp
Hydrat hóa Gián tiếp
Xúc tác
Axit Phosphoric rắn (H3PO4)
Axit Sulfuric lỏng (H2SO4)
Ăn mòn thiết bị
Thấp (Do xúc tác rắn)
Rất cao (Do axit lỏng)
Sản phẩm phụ
Ít (Chủ yếu là Ete)
Nhiều
Thân thiện môi trường
Cao (Green Chemistry)
Thấp (Nhiều thải axit)
4. Phản ứng ngược: Điều chế C2H4 từ C2H5OH (Tách nước)
Trong nhiều trường hợp, chúng ta cần thực hiện quá trình ngược lại: Tách nước từ cồn để thu khí Etilen. Đây là kiến thức quan trọng thường xuất hiện trong các bài kiểm tra và thực tế điều chế khí trong phòng thí nghiệm.
Phương trình phản ứng:
C2H5OH(H2SO4 đặc, 170 độ C) → C2H4 ↑ + H2O
Lưu ý đặc biệt về nhiệt độ (Kỹ thuật viên cần nhớ)
Sự khác biệt về nhiệt độ sẽ quyết định sản phẩm tạo thành. Rất nhiều người nhầm lẫn giữa hai mốc nhiệt độ sau:
- Tại 170 độ C: Xảy ra phản ứng tách (Elimination) → Tạo Etilen (C2H4).
- Tại 140 độ C: Xảy ra phản ứng thế (Substitution) → Tạo Ete (C2H5-O-C2H5 – Dietyl Ete).
Do đó, khi điều chế C2H4, việc kiểm soát nhiệt độ > 170 độ C là bắt buộc. Khí sinh ra thường được dẫn qua dung dịch NaOH để loại bỏ tạp chất CO2 và SO2 trước khi thu gom.
5. Ứng dụng thực tế và Thị trường
Sản phẩm của phản ứng này – Ethanol và Etilen – đều là những hóa chất thương mại có sản lượng tiêu thụ khổng lồ.
- Ethanol (C2H5OH):
- Dung môi công nghiệp: Dùng pha chế sơn, vecni, mực in (VIETCHEM hiện cung cấp các dòng dung môi này với độ tinh khiết >99%).
- Nhiên liệu: Phối trộn xăng sinh học E5, E10 giúp giảm khí thải nhà kính.
- Y tế & Dược phẩm: Cồn sát khuẩn 70 độ, 90 độ; dung môi chiết xuất dược liệu.
- Etilen (C2H4): Nguyên liệu đầu vào để sản xuất nhựa Polyetilen (PE), nhựa PVC, và kích thích quả chín trong nông nghiệp.
6. Cảnh báo an toàn & Bảo quản (Theo tiêu chuẩn MSDS/GHS)
Là đơn vị cung cấp hóa chất chuyên nghiệp, VIETCHEM luôn khuyến cáo khách hàng tuân thủ nghiêm ngặt các quy định an toàn khi xử lý Etilen và Ethanol.
- Nguy cơ cháy nổ:
- Etilen: Là khí dễ cháy, có thể tạo hỗn hợp nổ với không khí ở nồng độ từ 2.7% – 36%.
- Ethanol: Chất lỏng dễ cháy (Flash point approx 13 độ C). Ngọn lửa cồn có màu xanh nhạt, rất khó quan sát dưới ánh sáng mạnh, gây nguy hiểm tiềm tàng.
Biện pháp phòng ngừa:
- Bảo quản nơi thoáng mát, thông gió tốt, cách xa nguồn nhiệt, tia lửa điện.
- Sử dụng thùng chứa chuyên dụng, có nhãn dán cảnh báo theo chuẩn GHS.
- Khi có sự cố cháy: Sử dụng bột hóa học khô, bọt chống cháy (Alcohol-resistant foam), phun sương nước hoặc CO2. Tuyệt đối không dùng vòi phun nước trực tiếp vào đám cháy cồn lỏng vì có thể làm loang đám cháy.
Tài liệu tham khảo: Luôn đọc kỹ Phiếu an toàn hóa chất (MSDS) trước khi thao tác.
7. Mua hóa chất dung môi Ethanol (Cồn công nghiệp) ở đâu uy tín?
Việc lựa chọn nguồn cung cấp Ethanol và dung môi công nghiệp quyết định trực tiếp đến chất lượng sản phẩm đầu ra của doanh nghiệp (sơn, mực in, tẩy rửa…).

VIETCHEM tự hào là đơn vị cung ứng hóa chất hàng đầu Việt Nam với hơn 20 năm kinh nghiệm:
- Hệ thống kho bãi: Quy mô lớn tại Hà Nội, TP.HCM, Cần Thơ, đảm bảo nguồn hàng ổn định.
- Vận chuyển chuyên nghiệp: Đội xe bồn và xe tải chuyên dụng, tuân thủ quy định vận chuyển hàng nguy hiểm.
- Chất lượng cam kết: Ethanol công nghiệp, Cồn thực phẩm, Dung môi pha sơn đạt chuẩn quốc tế.
Quý khách hàng cần tư vấn kỹ thuật hoặc báo giá dung môi, vui lòng liên hệ:
- Hotline: 0826 010 010
- Website: https://vietchem.com.vn
- Trụ sở: Số 41 Phố Trạm, Phường Long Biên, Thành Phố Hà Nội
Tài liệu tham khảo:
- PubChem – Ethanol Compound Summary.
- Chemical Safety Facts – Ethylene Production.
- Sổ tay an toàn hóa chất VIETCHEM.