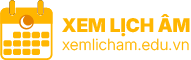Nhóm bor (nhóm 13) Số nhóm IUPAC 13 Tên theo nguyên tố nhóm bor IIIA IIIB ↓ Bảng tuần hoàn 2 Bor (B)5 Á kim 3 Nhôm (Al)13 Kim loại yếu 4 Gali (Ga)31 Kim loại yếu 5 Indi (In)49 Kim loại yếu 6 Thali (Tl)81 Kim loại yếu 7 Nihoni (Nh)113 Kim loại yếu
Legend
Nguyên tố tự nhiên Nguyên tố tổng hợp Atomic number color: Màu đen=thể rắn
Nhóm bor là các nguyên tố hóa học thuộc nhóm 13 của bảng tuần hoàn, bao gồm bor (B), nhôm (Al), gali (Ga), indi (In), thali (Tl) và nihoni (Nh). Nhóm này nằm trong khối p của bảng tuần hoàn. Các nguyên tố trong nhóm bor có đặc điểm là có ba electron hóa trị.[1]
Bor là một á kim, ít phổ biến trên Trái Đất. Các nguyên tố còn lại là kim loại yếu (nằm giữa kim loại và á kim trong bảng tuần hoàn). Nhôm là nguyên tố xuất hiện nhiều trên Trái Đất và là nguyên tố phổ biến thứ ba trong vỏ Trái Đất (8,3%).[2] Nihoni hiện tại chưa phát hiện trong tự nhiên, đây là một nguyên tố tổng hợp.
Một số nguyên tố nhóm 13 có vai trò trong hệ sinh thái. Bor là một nguyên tố vi lượng ở người và cần thiết cho một số loài thực vật. Thiếu bor làm cây cối phát triển còi cọc, trong khi dư thừa bor cũng ức chế sự phát triển. Nhôm không có vai trò sinh học, không có độc tính đáng kể, được coi là an toàn. Indi và gali có thể kích thích sự trao đổi chất;[3] gali có khả năng tự liên kết với các protein sắt. Thali có độc tính cao, can thiệp vào chức năng của nhiều loại enzym quan trọng. Nguyên tố này được sử dụng làm thuốc trừ sâu.[4]
Z Nguyên tố Số electron trên mỗi lớp vỏ 5 Bor 2, 3 13 Nhôm 2, 8, 3 31 Gali 2, 8, 18, 3 49 Indi 2, 8, 18, 18, 3 81 Thali 2, 8, 18, 32, 18, 3 113 Nihoni 2, 8, 18, 32, 32, 18, 3 (dự đoán)
Mặc dù nằm trong khối p, các nguyên tố trong nhóm bor, đặc biệt là bor và nhôm trong liên kết hóa học thường vi phạm quy tắc octet. Tất cả các nguyên tố của nhóm bor đều có hóa trị ba.
Hầu hết các nguyên tố trong nhóm bor đều có xu hướng dễ phản ứng theo chiều tăng dần số hiệu nguyên tử. Bor, nguyên tố đầu tiên trong nhóm, thường không phản ứng với nhiều nguyên tố ở nhiệt độ thường. Bor tạo thành nhiều hợp chất với hydro gọi là boran.[5] Boran đơn giản nhất là diboran B2H6.[6]
Các nguyên tố nhóm 13 tiếp theo là nhôm và gali, tạo thành ít muối hydride bền hơn, mặc dù cả AlH3 và GaH3 có tồn tại. Indi chưa có dữ liệu cho thấy có tạo muối hydride, ngoại trừ indi có trong các phức chất như phức phosphin H3InP(Cy)3.[7] Muối thali và hydro không bền, chưa tổng hợp được trong phòng thí nghiệm.
Một vài hợp chất hóa học phổ biến nhóm bor[6]
[8][9][10][11][12]Nguyên tố Oxide Hydride Fluoride Chloride Sulfide Bor (β/g/α)B2O3 B2H6 BF3 BCl3 B2S3 B2O B10H14 BF−4 B6O BH3 B2F4 B5H9 BF B6H12 B4H10 B6H2−6 B12H2−12 B20H26 Nhôm (γ/δ/η/θ/χ)Al2O3 (α/α`/β/δ/ε/θ/γ) AlH3 AlF3 AlCl3 (α/β/γ) Al2S3 Al2O Al2H6 AlO AlH4 AlH−4 Gali (α/β/δ/γ/ε) Ga2O3 Ga2H6 GaF3 GaCl3 GaS GaH4 GaCl2 GaH3 Ga2Cl4 Ga2Cl6 GaCl−4 Ga2Cl−7 Indi In2O3 InH3 InF3 InCl3 (α/β/γ) In2S3 In2O Thali Tl2O3 TlH3 TlF TlCl Tl2O TlH TlF3 TlCl3 TlO2 TlF3−4 TlCl2 Tl4O3 TlF2−3 Tl2Cl3 Nihoni (Nh2O)[a] (NhH) (NhF) (NhCl) NhOH (Nh2O3) (NhH3) (NhF3) (NhCl3) (NhF−6)
Tất cả các nguyên tố thuộc nhóm bor được biết là tạo thành oxide hóa trị ba, với hai nguyên tử liên kết cộng hóa trị với ba nguyên tử oxy. Những yếu tố này cho thấy xu hướng tăng pH (từ acid đến base).[13]
- ^ Cho đến nay, không có hợp chất nihoni nào được tổng hợp (ngoại trừ có thể là NhOH), và tất cả các hợp chất được đề xuất khác hoàn toàn là lý thuyết.
- ^ Kotz, John C.; Treichel, Paul & Townsend, John Raymond (2009). Chemistry and chemical reactivity. Quyển 2. Belmont, Ca, USA: Thomson Books. tr. 351. ISBN 978-0-495-38712-1.
- ^ “Soviet Aluminium from Clay”. New Scientist. 8 (191). One Shilling Weekly: 89. 1960.
- ^ Pharmacology and Nutritional Intervention in the Treatment of Disease edited by Faik Atroshi, page 45
- ^ Dobbs, Michael (2009). Clinical neurotoxicology: syndromes, substances, environments. Philadelphia, Pa: Saunders. tr. 276-278. ISBN 978-0-323-05260-3.
- ^ Raghavan, P. S. (1998). Concepts And Problems In Inorganic Chemistry. New Delhi, India: Discovery Publishing House. tr. 43. ISBN 81-7141-418-4.
- ^ a b Harding, A., Charlie; Johnson, David; Janes, Rob (2002). Elements of the p block. Cambridge, UK: The Open University. tr. 113. ISBN 0-85404-690-9.
- ^ Cole, M. L.; Hibbs, D. E.; Jones, C.; Smithies, N. A. (2000). “Phosphine and phosphido indium hydride complexes and their use in inorganic synthesis”. Journal of the Chemical Society, Dalton Transactions (4): 545-550. doi:10.1039/A908418E.
- ^ Downs, pp. 197-201
- ^ Daintith, John (2004). Oxford dictionary of chemistry. Market House Books. ISBN 978-0-19-860918-6.
- ^ Bleshinsky, S. V.; Abramova, V. F. (1958). Химия индия (bằng tiếng Nga). Frunze. tr. 301.
- ^ Downs, pp. 195-196
- ^ Henderson, p. 6
- ^ Jellison, G. E.; Panek, L. W.; Bray, P. J.; Rouse, G. B. (1977). “Determinations of structure and bonding in vitreous B2O3 by means of B10, B11, and O17 NMR”. The Journal of Chemical Physics. Quyển 66 số 2. tr. 802. Bibcode:1977JChPh..66..802J. doi:10.1063/1.433959. Truy cập ngày 16 tháng 6 năm 2011.